昼夜节律紊乱被视为癌症预后不良的一个标志,然而睡眠不足(SD)促进肿瘤发生的生理过程仍不明确;已有研究表明脂肪酸氧化(FAO)失调可增强肿瘤恶性特征,特别是作为FAO的限速酶,ACSL 1在癌症中高表达,但其节律性破坏的作用未知;已知β-内啡肽,一种内源性具有类似吗啡作用肽类物质,其昼夜振荡与生物钟稳态相关,具有抑制癌症的潜能,但不同的给药节律是否能减轻肿瘤尚待研究。
2024年5月,大连医科大学肿瘤干细胞研究院刘强教授团队在Cell Metabolism上发表了题为“Oncogenic fatty acid oxidation senses circadian disruption in sleep-deficiency-enhanced tumorigenesis”的研究论文近期,揭示了FAO是一种将睡眠不足与肺肿瘤发生联系起来的昼夜节律传感机制,并为患有睡眠不足相关癌症的患者提供了一种β-内啡肽时间节律治疗策略。
技术路线图
FAO:脂肪酸氧化;SD:睡眠不足/睡眠剥夺;ACSL1:酰基辅酶A合成酶长链家族成员1;PA:棕榈酸;PA-CoA:棕榈酰肉碱辅酶A;CLOCK:昼夜节律稳态核心基因
研究结果
1. 脂肪酸氧化可感知睡眠剥夺导致的节律紊乱
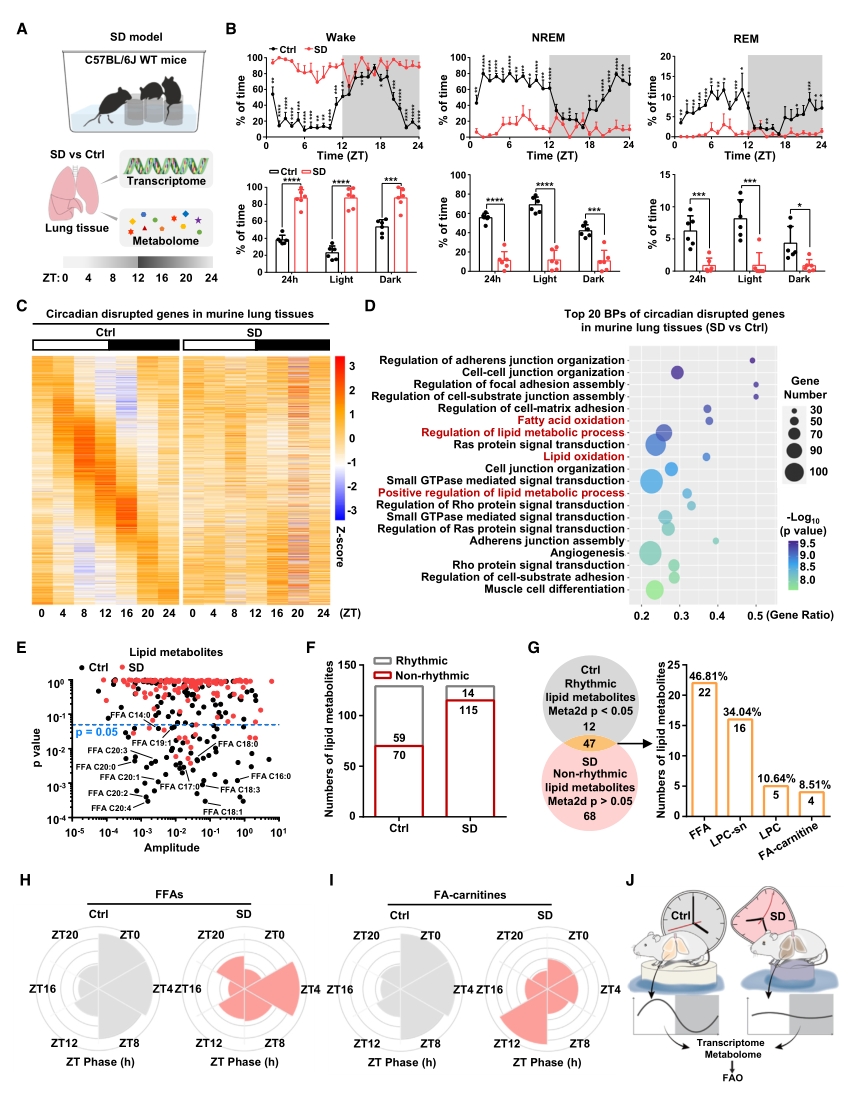
为了探究睡眠剥夺(SD)对小鼠肺部生理节律的影响,对SD处理后不同时间点的小鼠肺组织进行组学检测。转录组测序筛选出3284个在SD后丧失昼夜振荡的基因,GO富集分析显示这些基因在脂质代谢相关的生物过程中富集,尤其是脂肪酸氧化(FAO)。随后的UHPLC-MS代谢组学进一步证实,SD处理使得小鼠肺组织中昼夜振荡的脂质代谢物数量显著减少, 47种脂质物质发生节律紊乱,其中游离脂肪酸占比最大。
以上结果表明,在基因表达和代谢功能层面,FAO均能够感知生理条件下SD诱导的节律紊乱。
图1. FAO可感知SD处理导致的昼夜节律紊乱
2.睡眠剥夺通过脂肪酸氧化增强癌细胞干性
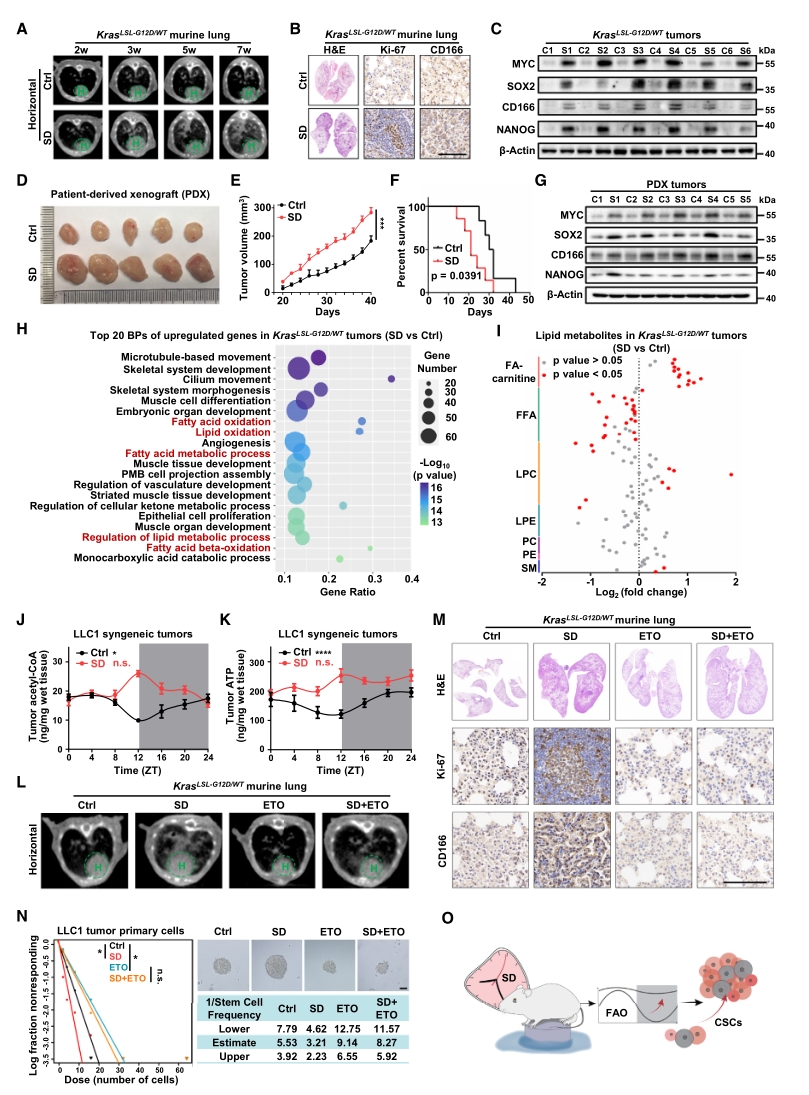
在此基础上,进一步探讨SD诱导的FAO节律紊乱是否在肺癌发展中发挥作用,为此构建了肺癌小鼠模型并实施SD处理,通过CT图像、HE染色和IHC等结果确认了肺癌形成和干细胞标志物的表达。
为明确SD促进肿瘤发生的机制,对小鼠肺癌组织进行转录组测序,结果显示SD显著上调了与FAO相关的基因表达。此外,脂质代谢组检测也表明,SD处理后脂肪酰肉碱增加,游离脂肪酸减少,且脂肪酸氧化的最终产物乙酰辅酶A和腺苷三磷酸在肺癌中增加,并在SD条件下表现出节律紊乱。此外,向SD小鼠给予脂肪酸氧化抑制剂:依托莫司他(ETO),可逆转肺癌进展及干细胞特性的增强。
以上结果表明,FAO感知昼夜节律紊乱是睡眠剥夺增强肺癌干细胞特性的基础。
图2. FAO节律紊乱增强SD诱导的肺癌细胞干性
3. ACSL1及其产物PA-CoA发挥重要作用
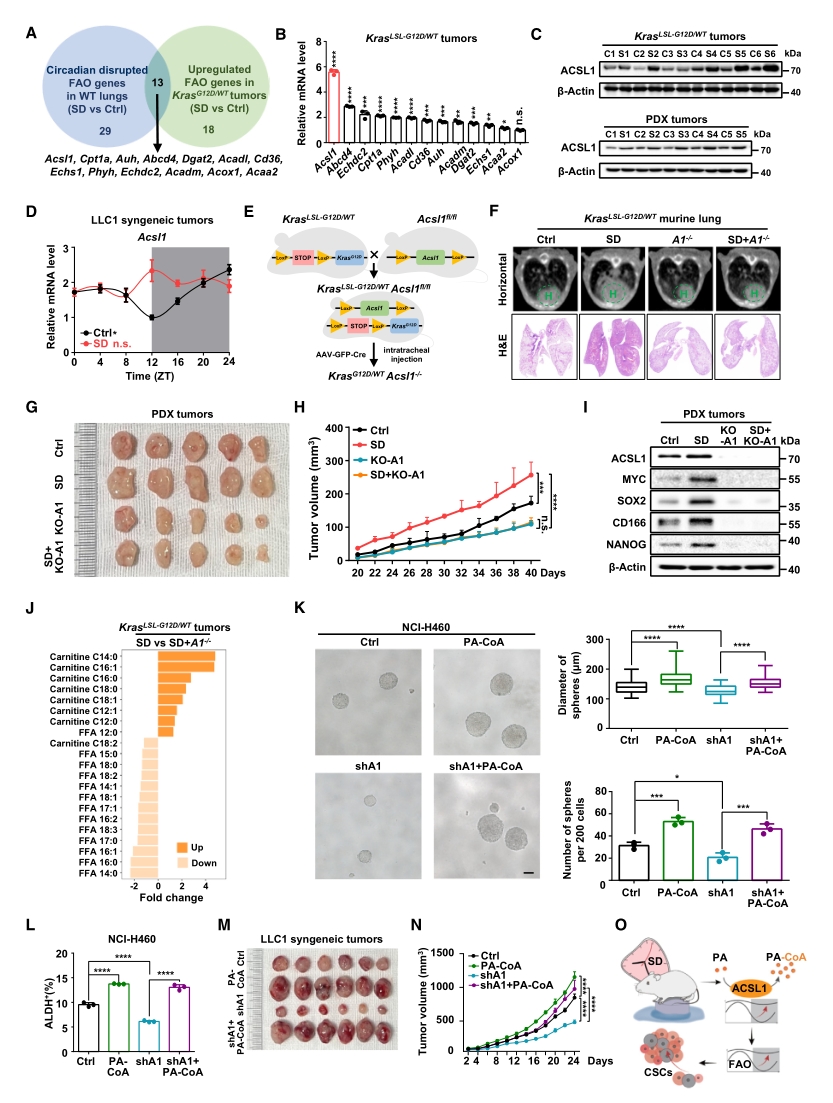
接下来寻找SD诱导FAO节律紊乱从而促进肺癌干细胞特性的关键分子。首先从转录组结果里筛选出13个同时响应节律紊乱和肿瘤进展的FAO基因,其中ACSL1在mRNA和蛋白水平均显著上调。在小鼠体内特异性敲除该基因可逆转SD促进的肿瘤进展,下调肿瘤组织中干细胞标志物的表达。
随后从脂质组检测结果里筛选可能作为ACSL1底物和产物的长链FAO代谢产物,发现SD可降低肿瘤组织中的棕榈酸(PA)水平。敲低ACSL1可恢复SD诱导的PA下降,而补充棕榈酰肉碱辅酶A(PA-CoA)——PA进入FAO的活化态,可挽救ACSL1缺失下被抑制的癌症干细胞特性和肿瘤生长。
以上结果表明,SD扰乱ACSL1的节律,过度激活了它将PA转化为PA-CoA的能力,从而促进FAO,最终导致肿瘤生长。
图3. ACSL1合成的PA-CoA有助于SD诱导的肺癌细胞干性
4. ACSL1的上游调控者是CLOCK
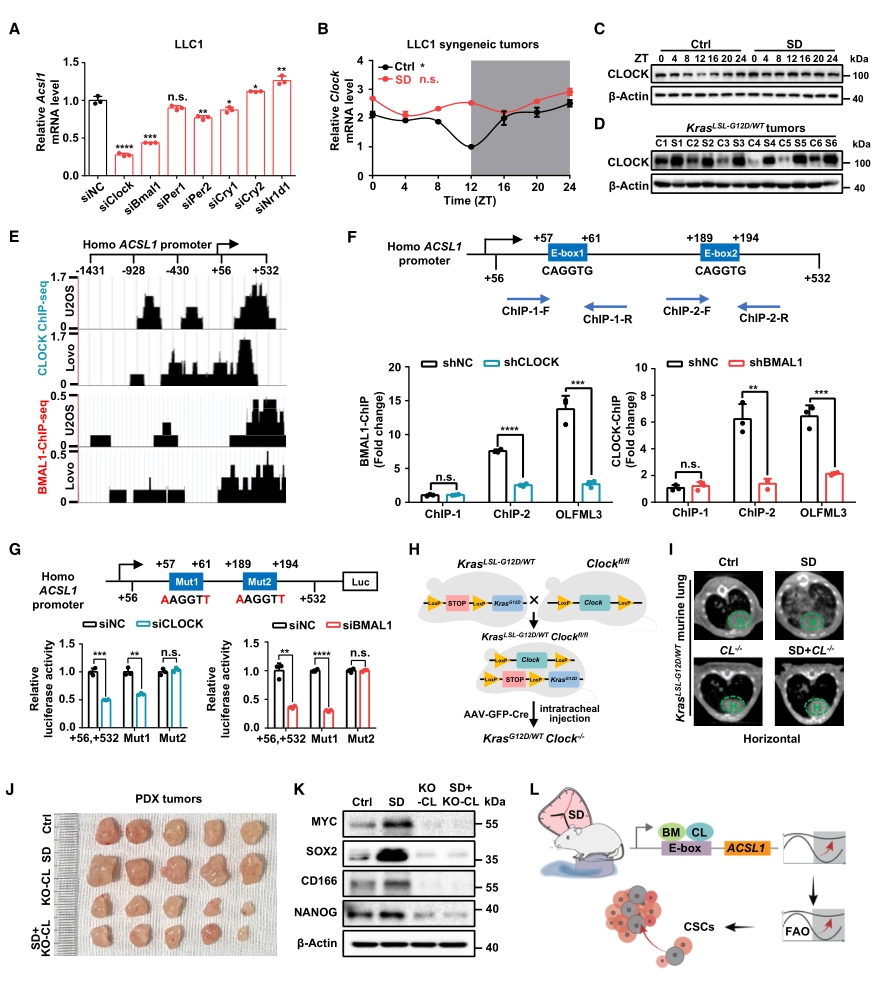
在分子机制方面,首先在不同的细胞系中发现有两种核心生物钟基因:CLOCK和BMAL1,与ACSL1的表达量正相关。随后在肿瘤模型中进行验证,发现SD仅破坏CLOCK基因的节律振荡,而对BMAL1无显著影响。此外,通过分析表观组学公共数据库,发现CLOCK和BMAL1在多种细胞中均占据了ACSL1的启动子区域,并且通过CHIP-qPCR和荧光素酶报告基因分析确认了结合位点。作为验证,分别在鼠源和人源两种肿瘤模型中敲除CLOCK基因,均观察到了肿瘤生长和干细胞特性被抑制的现象。
以上结果表明,核心生物钟基因CLOCK可能通过直接结合到ACSL1启动子上的特定区域来调控该基因的表达。
图4. ACSL1可感知SD诱导的FAO节律失常,促进肺癌发生
5. ACSL1诱导CLOCK发生棕榈酰化修饰,维持其稳定性
进一步的研究发现,敲低ACSL1会反过来降低CLOCK的蛋白水平,但不影响其mRNA水平,说明ACSL1可通过某些机制维持CLOCK的蛋白稳定性;同时考虑到ACSL1催化的PA-CoA可以做为蛋白质棕榈酰化的底物,因此研究者探讨了棕榈酰化修饰在ACSL1和CLOCK互作中的作用。
首先利用酰基-生物素交换(ABE)和免疫印记等技术手段,证实了CLOCK蛋白上确实存在棕榈酰化修饰。然后使用siRNA筛选出了23种可能的棕榈酰转移酶,通过敲低和过表达实验确定了其中的ZDHHC5可介导CLOCK的棕榈酰化。此外,还发现SD 处理一方面以ACSL1依赖的方式增强了CLOCK的棕榈酰化修饰,另一方面也破坏了这一修饰的昼夜节律性。随后,通过在线预测网站swisspalm鉴定了CLOCK的棕榈酰化位点:Cys194,该位点在多物种中保守。进一步地,CLOCK蛋白的降解和泛素化实验表明,棕榈酰化通过抑制泛素化依赖的蛋白酶体降解来稳定CLOCK蛋白。
以上结果表明,ACSL1通过ZDHHC5使得CLOCK在Cys194上发生棕榈酰化修饰,而这一修饰可阻止CLOCK因泛素化而降解,从而维持该蛋白的稳定性。
图5. ACSL 1通过ZDHHC 5对CLOCK进行棕榈酰化修饰,以此稳定CLOCK蛋白
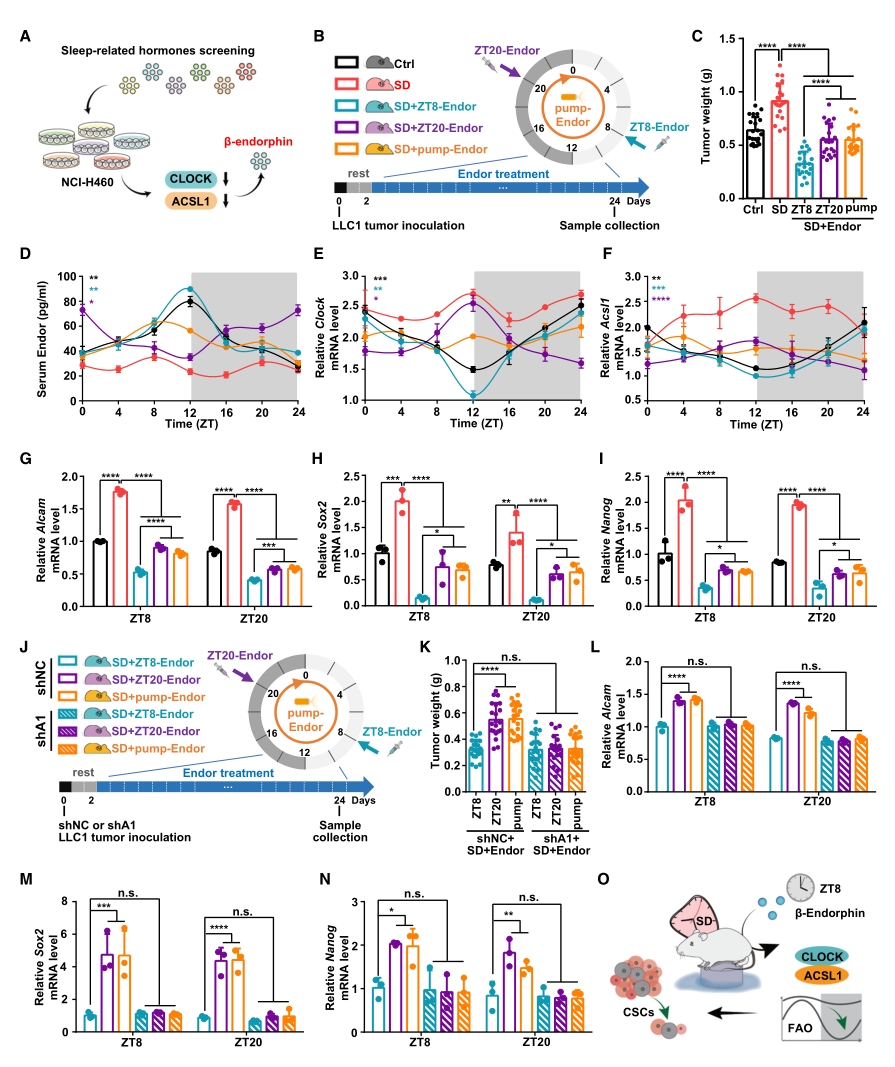
6. 节律性的β-内啡肽给药可作为一种治疗方案
基于上述SD对肿瘤发生发展的影响,研究者考虑基于昼夜节律的内分泌治疗方案。对体外培养的肺癌细胞系分别添加14种睡眠相关激素,发现β-内啡肽(Endor)可显著下调CLOCK和ACSL1的mRNA表达水平,因此后续对β-内啡肽展开节律治疗应用的研究。
对于SD条件下的荷瘤小鼠,研究人员设计了3种β-内啡肽给药方案:每日16:00给药(ZT8-Endor)、每日4:00给药(ZT20-Endor)以及持续给药(pump-Endor)。从表型来看,ZT8-Endor方案显著逆转了SD导致的肿瘤生长,而另外两种方案效果不显著。接下来使用ELISA评估了血清β-内啡肽水平,发现SD处理破坏了β-内啡肽的昼夜节律并使其保持在较低水平, 另外三种给药处理虽都能提高β-内啡肽含量,但仅ZT8-Endor能使其昼夜节律也恢复正常。同样地,在ACSL1和CLOCK含量和肿瘤干性标志物等指标上也存在类似的规律。
图6. β-内啡肽可恢复受到SD干扰的CLOCK/ACSL1节律
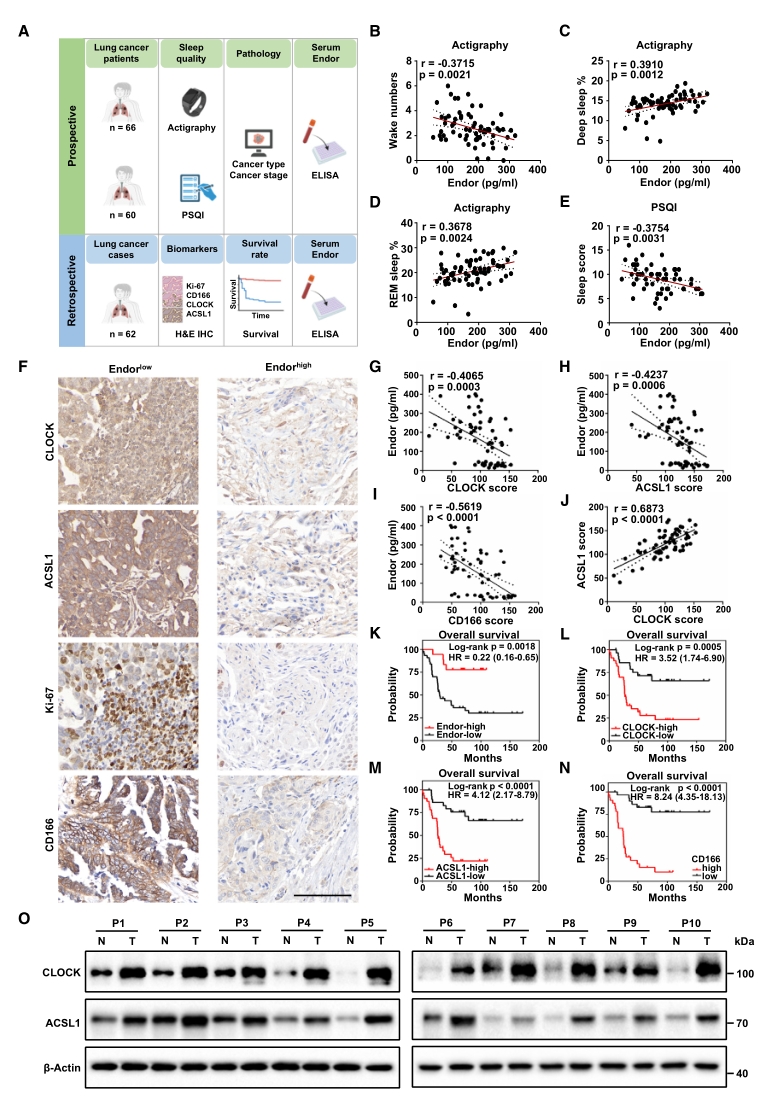
7. 人群队列验证
最后为评估以上研究的临床转化潜力,进行了人群队列的前瞻性和回顾性研究。肺癌患者的前瞻性队列数据表明,血清β-内啡肽浓度与睡眠质量正相关,且是癌症发展的潜在预测因素;既往肺癌病例的回顾性分析结果表明,血清β-内啡肽与较好的预后和生存率有关,而与CD166和Ki-67(两种肿瘤标志物)的表达水平负相关。
总而言之,这两组队列数据提供了SD、β-内啡肽、CLOCK和ACSL1可能是肺癌独立预后因素的临床证据。
图7. 肺癌患者的睡眠质量和β-内啡肽水平与CLOCK/ACSL1表达及预后不良呈负相关
研究结论
本研究揭示了睡眠不足(SD)与肺癌发生发展之间的潜在机制,发现了SD可导致脂肪酸氧化(FAO)紊乱,进而促进肺癌干细胞的形成和肿瘤生长。在这一过程中,ACSL1基因与CLOCK基因之间的正反馈循环起到了关键作用。在治疗阶段,通过定时给予β-内啡肽,可以有效逆转SD引起的昼夜节律紊乱和FAO紊乱,从而减轻肿瘤的生长。此外,研究证实睡眠质量和血清β-内啡肽水平与肺癌患者的预后不良密切相关。这一发现表明,FAO作为一种昼夜节律感知机制,在连接睡眠不足与肺肿瘤进展方面具有重要意义。
参考文献
Peng F, Lu J, Su K, et al. Oncogenic fatty acid oxidation senses circadian disruption in sleep-deficiency-enhanced tumorigenesis. Cell Metab. 2024.
请扫描二维码阅读原文
绘谱帮你测
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。