非酒精性脂肪性肝病(NAFLD)是一种影响着全球约1/4人口的常见肝脏疾病。近些年来,在中国,随着生活方式和饮食结构的改变,NAFLD的患病率也呈逐年上升的趋势,患病人群也更加“年轻化”,且包括不少肥胖人群和糖尿病患者。此外,NAFLD不仅仅与肝脏健康问题相关,还与心血管疾病等其他慢性疾病风险增加高度相关,因此,对NAFLD的预防与治疗至关重要。然而,由于NAFLD的发病机制复杂,存在较大的个体异质性,目前全世界范围内尚无获批的临床治疗药物【1】。
胆汁酸(BAs)是一组胆固醇在肝细胞内经过一些列的酶反应而合成的两亲分子,进食后被释放到肠道中,进一步经过肠道菌的去结合、脱羟基化、氧化和差向异构化等作用将初级胆汁酸转化为次级胆汁酸(相关阅读:Microbiome|一文读懂·体内胆汁酸的微生物转化途径)。近些年来,越来越多的研究发现,胆汁酸可以通过与其受体结合,广泛参与调节机体的糖脂代谢,介导代谢性疾病的发生发展【2-4】。
上海交通大学医学院附属第六人民医院贾伟教授团队在前期工作中揭示,猪体内一类占比最高的非12羟基胆汁酸-猪胆酸类(HCA species),具有调节血糖稳态、预测糖尿病风险的潜力【5,6】。(相关阅读:绘谱创新︱猪胆酸–如何被研究猎人强势捕获)然而,其对于肝脏脂质代谢的调控,目前尚不清楚。
2023年8月16日,上海交通大学医学院附属第六人民医院转化医学中心/上海市糖尿病重点实验室贾伟教授、郑晓皎研究员、贾伟平院士团队在Cell Metabolism(IF=29)杂志在线发表了题为“Hyodeoxycholic acid alleviates non-alcoholic fatty liver disease through modulating the gut-liver axis”的研究论文,揭示了猪去氧胆酸通过肠-肝轴治疗非酒精性脂肪肝的新机制,并提供了潜在的靶点与干预手段【7】。
临床队列与动物模型胆汁酸定量分析
【临床队列】
队列1:178名NAFLD患者和73名健康受试者;
队列2:312名肝脏脂肪变性患者和208名健康受试者。
对临床人群的血清胆汁酸谱分析显示,发现猪胆酸类(HCAs)/总胆酸(TBA),特别是猪去氧胆酸(HDCA),随着NAFLD活动度评分(NAS)的增加而逐渐降低,且与临床代谢和病理指标呈显著负相关。
【小鼠模型验证】
模型1:高脂饮食诱导的脂肪肝小鼠模型;
模型2:STAM小鼠模型,模拟人NAFLD病程(脂肪肝、炎症细胞浸润、肝纤维化、肝癌)。
小鼠肝脏胆汁酸谱显示,在NAFLD进展的不同阶段,HDCA水平都显著低于对照组。
因此,基于胆汁酸定量分析发现,NAFLD临床患者体内HDCA水平显著下降,并在动物模型中得到验证(图1)。

图1. 临床队列与动物模型胆汁酸定量分析
HDCA干预改善NAFLD表型
在多种NAFLD模型小鼠中,用HDCA和富含HDCA的猪胆粉干预。结果显示, HDCA显著降低了肝细胞内积聚的多余脂滴和肝脏重量,改善葡萄糖耐量和胰岛素敏感性;肝脏脂质合成相关基因Srebp1c, Acc-1, Fas和脂滴形成相关基因Cidea的表达水平均显著下降。因此,回补NAFLD中耗竭的HDCA显著改善脂肪肝表型,值得进一步的机制探究(图2)。
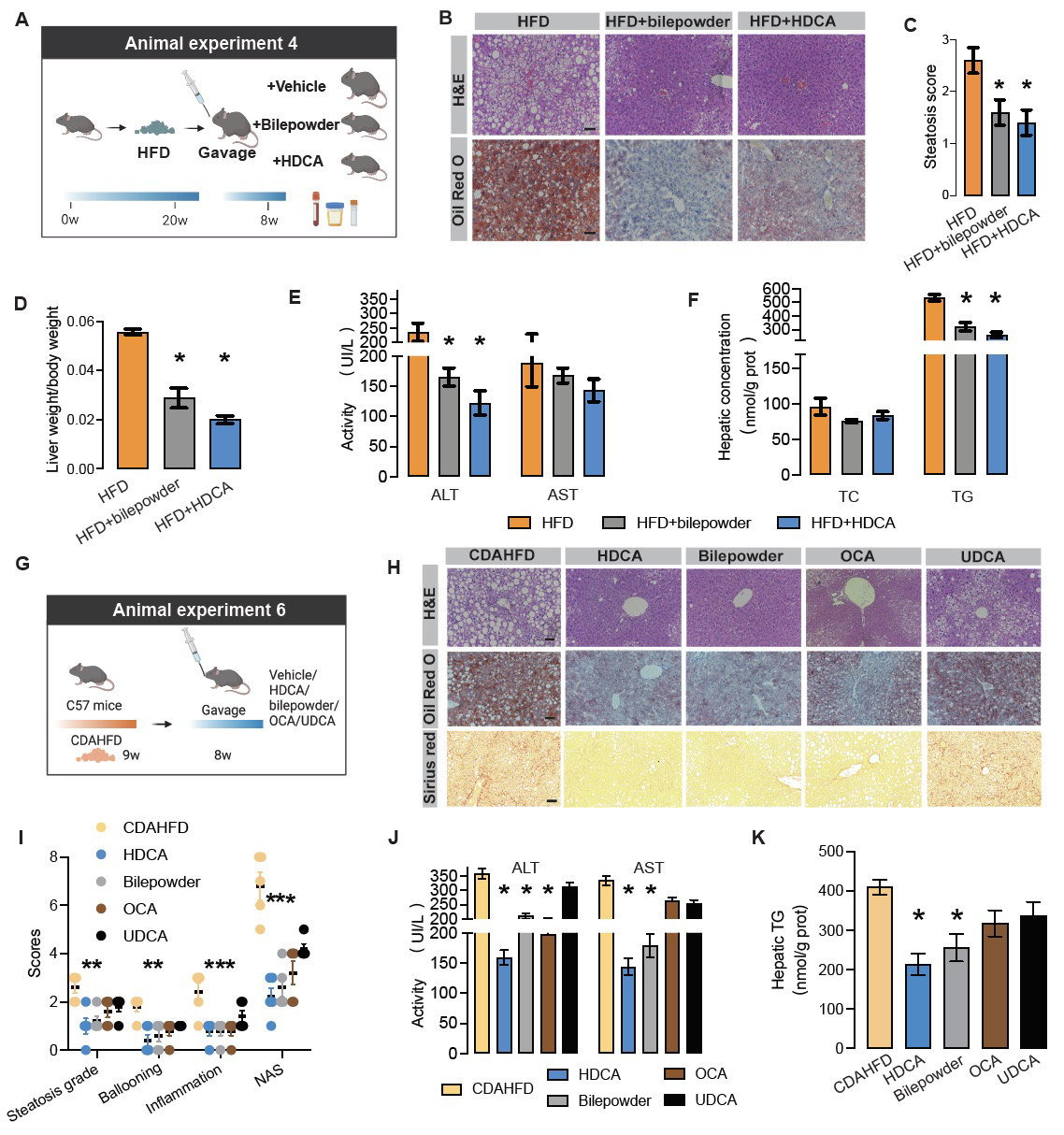
图2. HDCA干预改善NAFLD表型
HDCA发挥作用的肝脏关键靶点
为了探究HDCA缓解肝脏脂质代谢的分子机制,研究人员对小鼠肝脏进行转录组测序分析,发现肝脏胆汁酸替代途径合成酶-CYP7B1显著上调,而经典途径合成酶-CYP7A1显著下调,表明HDCA的干预促使胆汁酸的合成由经典途径转向替代途径。胆汁酸替代合成途径已被证明在调节机体代谢中发挥着至关重要的作用【8】。进一步在小鼠肝脏CYP7B1基因敲低/敲除和过表达实验证实CYP7B1在缓解肝脏脂肪变性中的关键作用。因此,CYP7B1驱动的胆汁酸替代途径是HDCA发挥作用的肝脏关键靶点(图3)。
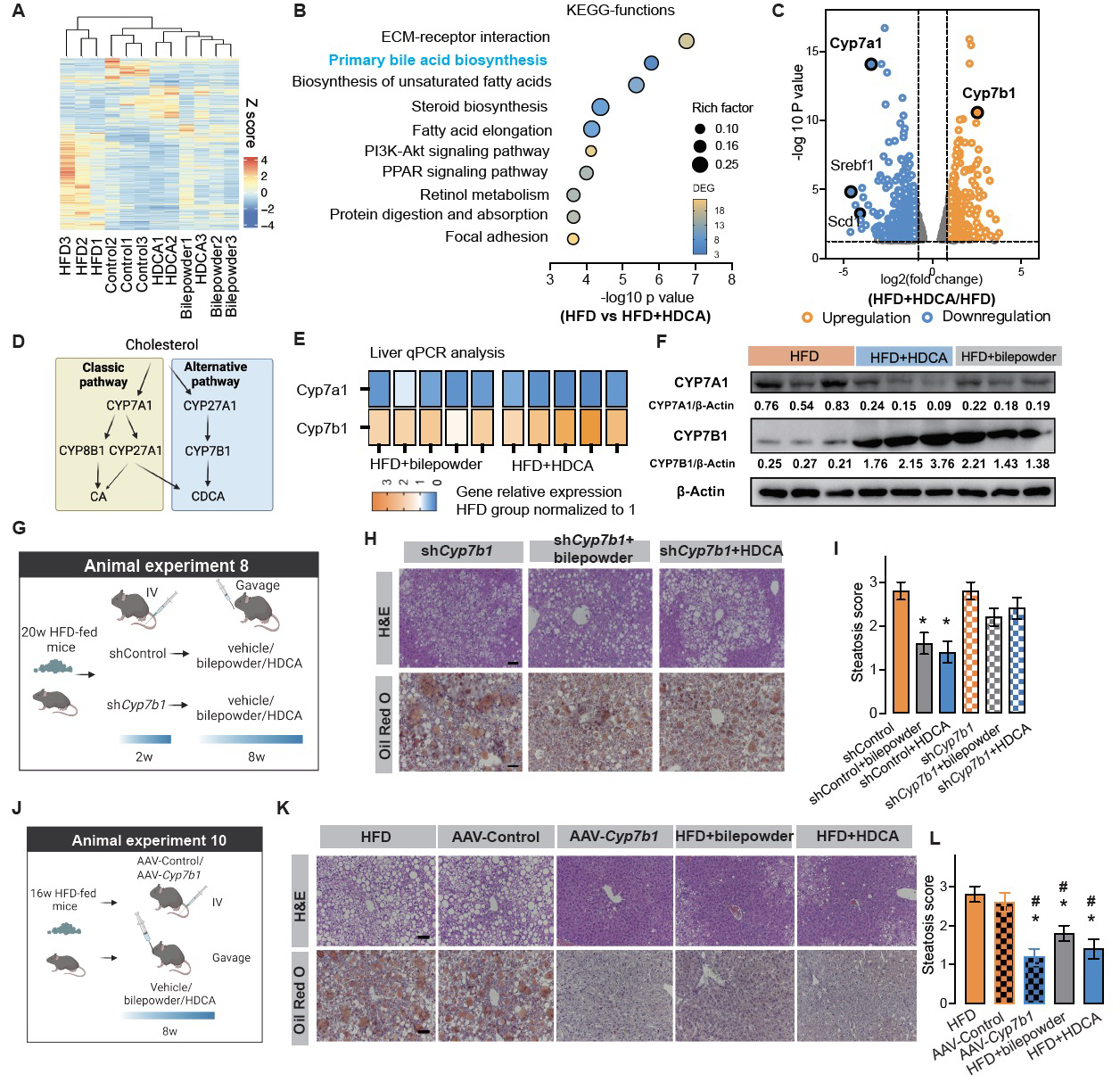
图3. HDCA发挥作用的肝脏关键靶点
HDCA通过肠-肝轴的核心调控机制
HDCA如何影响CYP7B1和CYP7A1酶的表达,缓解脂肪肝表型?
研究人员发现,HDCA体外直接干预棕榈酸诱导的肝脏细胞,并不能缓解细胞脂质堆积。研究人员推测可能存在其他因素在发挥作用,考虑到多项研究已证实器官之间交流,特别是肠-肝轴在调节代谢稳态中的表现突出,因此推测HDCA的潜在作用靶点并非肝脏本身,而是通过肠道,进一步缓解肝脏脂肪变性。
一方面,研究人员发现HDCA可以显著抑制肠道FXR信号通路,通过下游分泌蛋白FGF15/19调控CYP7A1和CYP7B1。
另一方面,研究人员发现HDCA还可以调控肠道菌群结构。通过粪菌移植明确,肠道菌群在HDCA治疗肝脏脂肪变性中起着关键作用。一种益生菌-狄氏副拟杆菌(Parabacteroides distasonis)在HDCA干预后丰度显著增高,体外实验证明HDCA可以直接促进P. distasonis的生长,通过口服P. distasonis单菌定植显著缓解了小鼠肝脏脂肪积累。通过P. distasonis体内干预和体外培养,结合代谢组学检测,研究人员发现P. distasonis通过产生γ-亚麻酸发挥肝脏调控作用。通过体外细胞实验、荧光素酶报告基因等实验发现,HDCA干预后γ-亚麻酸激活PPARα通路,调控肝脏胆汁酸合成酶的表达,下调CYP7A1的表达。
最后,研究人员在体外验证HDCA通过肠道来源的分泌蛋白和代谢物作用于肝脏靶点。实验通过肠道FXR下游分泌蛋白FGF19和肠道菌群产生的代谢物γ-亚麻酸(PPARα激动剂)作用于原代肝细胞,证实了对肝脏CYP7A1和CYP7B1的调控作用。此外,研究人员很惊喜的发现,激活肝脏细胞的PPARα可以上调FXR的表达,这也为后续研究FXR的肠肝对话提供了新的方向与思路(图4)。
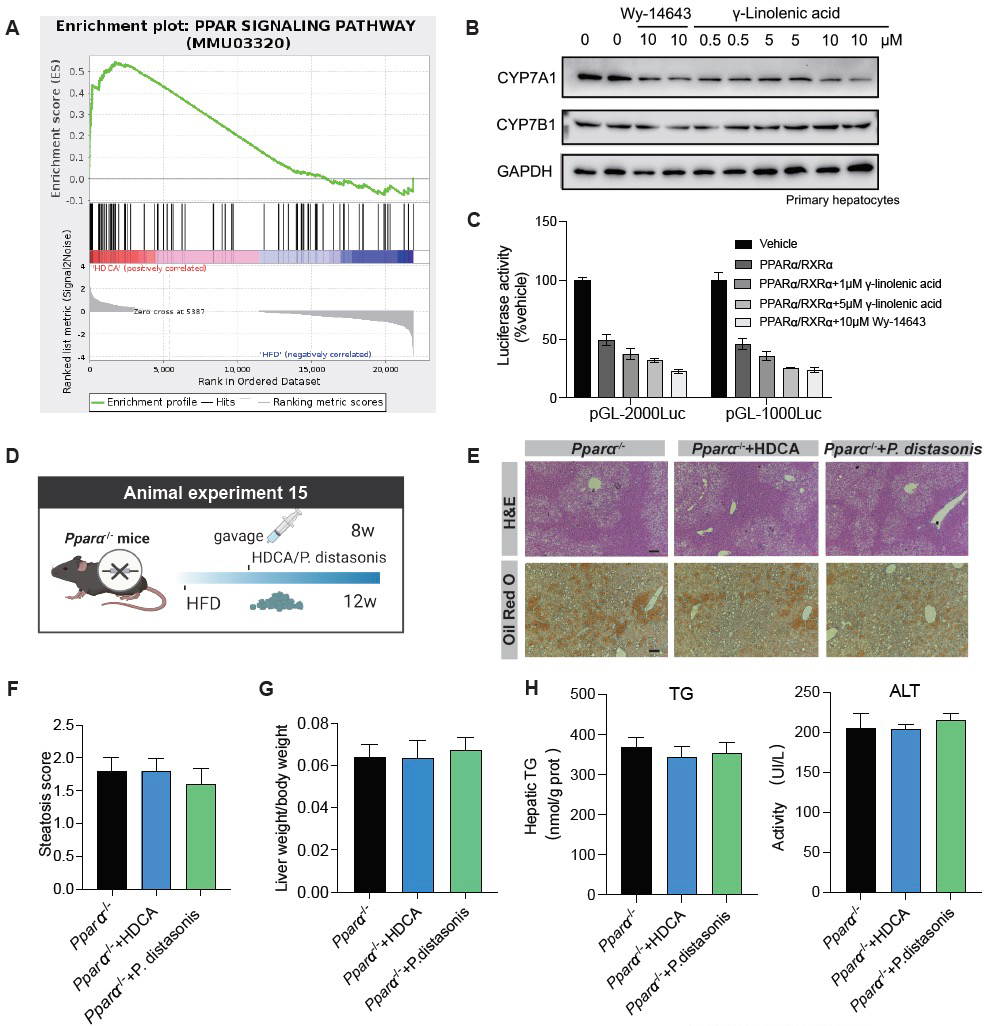
图4. HDCA通过肠-肝轴的核心调控机制
小结
综上所述(图5),该研究阐明了内源性HDCA通过肠(肠道菌群与肠道FXR信号通路)-肝脏(CYP7B1、PPARα)轴缓解肝脏脂质堆积,HDCA改变肠道菌群提供有利于P. distasonis生长的微环境,产生γ-亚麻酸并通过PPARα信号传导抑制肝脏CYP7A1经典胆汁酸合成通路,从而改善非酒精性脂肪性肝病,上述机制为代谢性疾病中多器官对话机制性研究提供了新的理论依据,同时为非酒精性脂肪性肝病的防治提供了新的治疗策略。
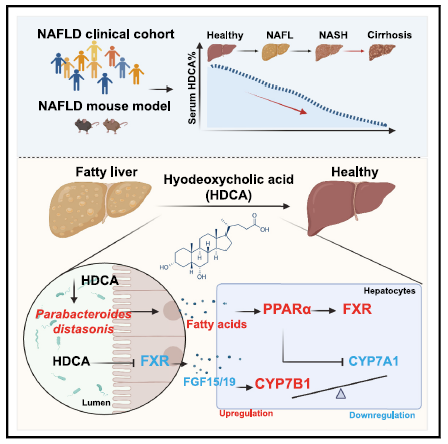
图5. 研究小结
上海交通大学医学院附属第六人民医院贾伟教授、郑晓皎研究员以及贾伟平院士为本研究的共同通讯作者。上海交通大学医学院附属第六人民医院转化医学中心博士研究生况俊良为本文第一作者。
参考文献
1. Tsochatzis EA. Natural history of NAFLD: knowns and unknowns. Nat Rev Gastroenterol Hepatol. 2022 Mar;19(3):151-152.
2. Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nat Rev Gastroenterol Hepatol. 2018 Feb;15(2):111-128.
3. Jia W, Li Y, Cheung KCP, et al. Bile acid signaling in the regulation of whole body metabolic and immunological homeostasis. Sci China Life Sci. 2023 Jul 27.
4. Li M, Wang S, Li Y, et al. Gut microbiota-bile acid crosstalk contributes to the rebound weight gain after calorie restriction in mice. Nat Commun. 2022 Apr 19;13(1):2060.
5. Zheng X, Chen T, Zhao A, et al. Hyocholic acid species as novel biomarkers for metabolic disorders. Nat Commun. 2021 Mar 5;12(1):1487.
6. Zheng X, Chen T, Jiang R, et al. Hyocholic acid species improve glucose homeostasis through a distinct TGR5 and FXR signaling mechanism. Cell Metab. 2021 Apr 6;33(4):791-803.e7.
7. Kuang J, WangJ, Li Y. et al. Hyodeoxyholic acid alleviates non-alcoholic fatty liver disease through modulating the gut-liver axis. Cell Metab. 2023
8. Jia W, Wei M, Rajani C, et al. Targeting the alternative bile acid synthetic pathway for metabolic diseases. Protein Cell. 2021 May;12(5):411-425.
绘谱帮你测
上述研究所涉及的胆汁酸谱、脂肪酸谱分析麦特绘谱均能够提供专属性检测及研究方案,同时拥有Q200/Q300/Q500/Q1000全定量代谢组、同位素示踪代谢流、能量代谢、神经递质、色氨酸代谢等共50+套各类小分子代谢物单独检测方法,协助客户发表Nature, Science, Cell Host & Microbe, Cell Metabolism, Gut, Nature Communications等国际期刊。详情请咨询绘谱热线400-867-2686,获取详细资料!
往期回顾
1. Advanced Science | 胃胆汁酸-微生物促进胆汁反流性胃癌发生新机制
2. Nature Communications | 肠道菌-胆汁酸代谢作用有效减轻节食后体重反弹
3. Protein&Cell | 胆汁酸替代合成途径与代谢性疾病
4. Nature Communications │ 普洱茶通过影响肠-肝对话发挥减肥降脂的功效
6. 客户案例 | 胆汁酸谱助力代谢顶刊发表!潜在新药物为NASH治疗带来希望
7. 客户案例 | Nature主刊:新机制!肠道菌群如何通过改变饮食成分来影响宿主免疫

